Na aula prática dessa semana vocês aprenderam a preparar câmara úmida para o desenvolvimento de fitopatógenos na superfície da planta hospedeira e métodos de isolamentos de microrganismos.
1-Câmara úmida
Objetivo: expor o material vegetal a um ambiente úmido para que ocorra o desenvolvimento das estruturas do patógeno na superfície da lesão.
Qualquer parte da planta (folha, flores, ramos, etc) pode ser acondicionada em um recipiente (sacos plásticos, caixa plástica, placa de Petri, etc) fechado contendo um algodão ou papel umedecido com água. O interior do recipiente ficará úmido e assim estimulará o crescimento das estruturas do patógeno na lesão do material vegetal. O período de acondicionamento do material vegetal dentro da câmara úmida pode variar, no entanto, na maioria dos casos, 24 horas é suficiente para estimular o desenvolvimento das estruturas.
Observação: A câmara úmida é utilizada para exteriorizar as estruturas de fungos.
2-Métodos de isolamento de fungos fitopatogênicos
Consiste na obtenção do patógeno em cultura pura a partir de tecidos doentes do hospedeiro, solo ou substrato.
Os fungos fitopatogênicos raramente ocorrem isolados na natureza, em seu habitat natural, obrigando-nos quando queremos estudar um organismo isoladamente, algumas, vezes até mesmo para identificá-lo, recorrer a técnicas especiais para isolá-lo de outros organismos contaminantes.
Antes de isolar um organismo, particularmente em se tratando de material vegetal doente, os tecidos devem ser examinados para ver se há presença de estruturas fúngicas no órgão vegetal lesionado. Se estes apresentarem de estruturas é aconselhável identificá-lo em seu habitat natural, visto que muitos fungos, diante de substrato rico em nutrientes, podem levar muito tempo para produzir estruturas que possibilitem indentificá-los.
Uma planta doente possui microflora composta do parasita primário (agente causal da doença) e de organismos saprofíticos. Para isolar o agente patogênico, em cultura pura, é necessário separa-lo da microflora saprofítica, através de técnicas que favoreçam seu desenvolvimento, em detrimento do crescimento dos outros. Existem diversos métodos com tal propósito, os quais variam segundo a natureza do agente patogênico bem como dos tecidos vegetais afetados.
Em todos os métodos faz-se necessário conservar a maior assepsia, possível para evitar contaminações externas que possam ocasionar o fracasso das investigações. Deste modo, flambar alças e agulhas de platina, placas de Petri, tubos de ensaio, bisturis, pinças, etc., com ou sem álcool é imprescindível; a mesa de trabalho e a câmara de fluxo laminar também devem ser desinfestados, preferencialmente com álcool a 70 %.
- Escolha dos tecidos infectados; o isolamento deve ser feito de tecidos apresentando os sintomas característicos da doença. Pequenos fragmentos de tecido da região limítrofe entre a área lesionada e a área sadia devem ser retirados da planta doente, pois é nestas áreas que o patógeno se encontra em franca atividade. Áreas necróticas, no centro das lesões, normalmente contém alta população de saprófitas e devem ser evitadas.
- Desinfestação superficial dos tecidos; de um modo geral, é realizada molhando-se os tecidos em álcool 50 – 70% por 30 – 60 segundos (para quebrar a tensão superficial e expor o tecido com o hipoclorito) seguido de tratamento com hipoclorito de sódio (1 a 2%) de princípio ativo, durante 1 a 5 minutos. Quando os tecidos são volumosos, espessos ou suculentos (raízes grossas,folhas e frutos carnosos, troncos, etc.) e o patógeno atinge camadas profundas, a superfície dos tecidos pode ser desinfestada aumentando a concentração do desinfestante, o tempo de exposição, ou ambos. Se, por outro lado, os tecidos são delicados e as estruturas do patógeno pouco profundas há o risco de matá-lo com a desinfestação, sendo preferível lavar demoradamente a superfície dos tecidos com água destilada, esterilizada e então remover a epiderme e cultivar os tecidos subjacentes, contendo o patógeno.
Métodos de isolamentos:
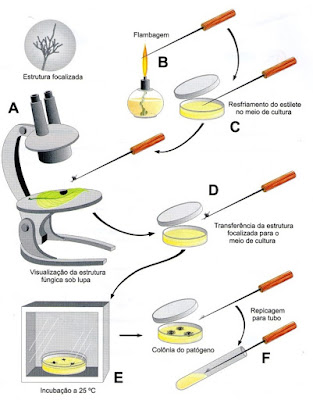
- Isolamento direto: é uma prática útil no caso em que o patógeno apresenta frutificações (conídios, picnídios, peritécios, apotécios, acérvulos, etc) ou quando não as apresenta mas é possível obtê-las, deixando os órgãos infectados em câmara úmida durante 1 a 2 dias. Os órgãos com as lesões contendo as estruturas são observados sob microscópio e, com auxílio de uma agulha, estilete ou microbisturí devidamente flambados, esfriados e umedecidos no meio de cultura que iremos utilizar, recolhemos algumas estruturas (frutificações) e as transportamos para os tubos de ensaio ou placas de Petri com o meio.
Isolamento direto de fungo a partir de suas estruturas formadas na superfície do hospedeiro
- Isolamento indireto: é utilizado quando se tem o material muito contaminado por organismos secundários e seja difícil a sua desinfestação superficial, ou quando se pretenda fazer uma separação preliminar do patógeno, antes de isolá-lo. Fragmentos são retirados da área limítrofe entre tecido sadio e lesionado e posteriormente desinfestados em álcool 70% durante 30 -60 segundos, hipoclorito de sódio durante 30 segundos e lavagem em água destilada para retirada do excesso do hipoclorito. Os fragmentos desinfestados são transferidos para o meio de cultura e posterior armazenamento para crescimento da colônia.
Isolamento indireto de fungo a partir de fragmentos do tecido lesionado do hospedeiro
Observação: o isolamento direto diminui as chances de contaminações quando comparado ao isolamento indireto.

Nenhum comentário:
Postar um comentário